
Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
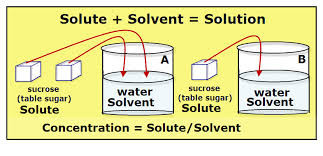
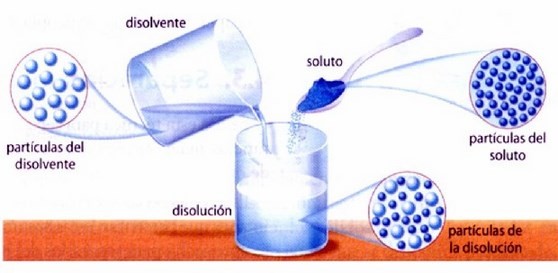
III) Los componentes de una solución son soluto y solvente.
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.
ACTIVIDAD
Contesta en tu cuaderno:
1. Escribe 10 ejemplos de soluciones que haya en tu hogar.
2. Consulta en que consiste el efecto Tyndall, utiliza un dibujo para ello.
3. Copia las fórmulas para calcular la concentración de una solución, según el vídeo anterior.
4. Observa cualquier vídeo donde se utilicen las fórmulas anteriores.
5. Resolver el siguiente taller:
Problemas de concentración de soluciones
1. ¿Cuántos gramos de soluto y de solvente tendrán 320 g de solución cuya concentración es 5 % m/m?
2. Averigua la molaridad de una disolución que contiene 58,8 g de yoduro de calcio CaI2, por litro.
3. Calcular los gramos que hay que pesar de una sustancia, para preparar una disolución de 100 ml y a un % m/v de 20g/l .
4. Determina cuántos gramos de hidróxido de calcio, Ca(OH)2, hay en 500 ml de disolución 0,6 M.
5. ¿Cuántos gramos de ácido nítrico, HNO3, se encuentran en 200 ml de una disolución 2,5 M?
6. ¿Qué volumen tendrá una solución que es 2 M y contiene 18 g de hidróxido de potasio (KOH)?
7. Calcula la masa de soluto que tendría una solución de 220 g que es 4% m/m.
8. Calcula la molaridad de la disolución que resulta de añadir 3 g de hidróxido de magnesio, Mg(OH)₂, a 150 ml de disolución 0,5 M.
9. Disolvemos 45 g de amoniaco NH3 en 500 g de agua . Calcula el porcentaje en peso de la disolución.
10.Calcula la M de una solución que tiene 8 g de hidróxido de sodio (NaOH) en 680 ml de solución.
11.¿Cuantos gramos de soluto tendrán 1200 ml de solución cuya concentración es de 6% m/v?
12.¿Cuál será la molaridad de una solución que contiene 64 g de Metanol en 500 ml de solución?
13.¿Qué volumen tendrá una solución al 5% m/v que contiene 80 g de soluto?
14.¿Cuántos g de ácido nítrico, HNO3, habrá en 850 ml de una solución 3,4M?
“ El responsable es aquel que responde por sus actos, se hace cargo
de sus consecuencias y aprende de ellas.”
