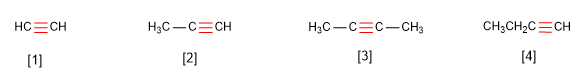Unidad No. 2 “Hidrocarburos Alifáticos”
Hidrocarburos Saturados: Los Alcanos
¿Qué son?
Son compuestos de C e H (de ahí el nombre de hidrocarburos) de cadena abierta que están unidos entre sí por enlaces sencillos (C-C y C-H).
Su fórmula empírica es CnH2n+2, siendo n el nº de carbonos.
Los cuatro primeros tienen un nombre sistemático que consiste en los prefijos met-, et-, prop-, y but- seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos griegos que indican el número de átomos de carbono y la terminación "-ano".
| Fórmula | Nombre | Radical | Nombre |
|
|
Metano |
|
Metil-(o) |
|
|
Etano |
|
Etil-(o) |
|
|
Propano |
|
Propil-(o) |
|
|
Butano |
|
Butil-(o) |
|
|
Pentano |
|
Pentil-(o) |
|
|
Hexano |
|
Hexil-(o) |
|
|
Heptano |
|
Heptil-(o) |
|
|
Octano |
|
Octil-(o) |
Otros nombres de la serie de los alcanos son los siguientes:
:
| Nº de C | Nombre | Nº de C | Nombre |
| 9 | nonano | 30 | triacontano |
| 10 | decano | 31 | hentriacontano |
| 11 | undecano | 32 | dotriacontano |
| 12 | dodecano | 40 | tetracontano |
| 13 | tridecano | 41 | hentetracontano |
| 14 | tetradecano | 50 | pentacontano |
| 15 | pentadecano | 60 | hexacontano |
| 16 | hexadecano | 70 | heptacontano |
| 17 | heptadecano | 80 | octacontano |
| 18 | octadecano | 90 | nonacontano |
| 19 | nonadecano | 100 | hectano |
| 20 | icosano | 200 | dihectano |
| 21 | henicosano | 300 | trihectano |
| 22 | docosano | 579 | nonaheptacontapentahectano |
Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo.
Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura.
- Se elige la cadena más larga. Si hay dos o más cadenas con igual número de carbonos se escoge la que tenga mayor número de ramificaciones.
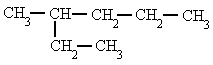
|
| 3-metilhexano |
- Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible.
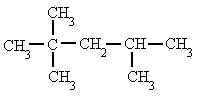
|
| 2,2,4-trimetilpentano, y no 2,4,4-trimetilpentano |
- Las cadenas laterales se nombran antes que la cadena principal, precedidas de su correspondiente número localizador y con la terminación "-il" para indicar que son radicales.
- Si un mismo átomo de carbono tiene dos radicales se pone el número localizador delante de cada radical y se ordenan por orden alfabético.
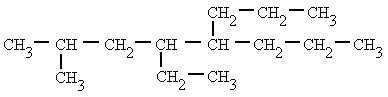
|
| 4-etil-2-metil-5-propiloctano |
- Si un mismo radical se repite en varios carbonos, se separan los números localizadores de cada radical por comas y se antepone al radical el prefijo "di-", "tri-", "tetra-", etc.
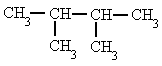
|
| 2,3-dimetilbutano |
- Si hay dos o más radicales diferentes en distintos carbonos, se nombran por orden alfabético anteponiendo su número localizador a cada radical. en el orden alfabético no se tienen en cuenta los prefijos: di-, tri-, tetra- etc. así como sec-, terc-, y otros como cis-, trans-, o-, m-, y p-; pero cuidado si se tiene en cuenta iso-.
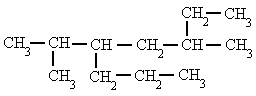
|
| 5-isopropil-3-metiloctano |
- Si las cadenas laterales son complejas, se nombran de forma independiente y se colocan, encerradas dentro de un paréntesis como los demás radicales por orden alfabético. En estos casos se ordenan por la primera letra del radical. Por ejemplo, en el (1,2-dimetilpropil) si tendremos en cuenta la "d" para el orden alfabético, por ser un radical complejo. En las cadenas laterales el localizador que lleva el número 1 es el carbono que está unido a la cadena principal.
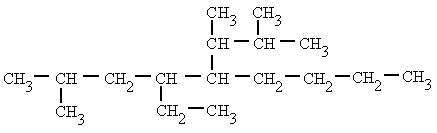
|
| 5-(1,2-dimetilpropil)-4-etil-2-metilnonano |
-
Si los localizadores de las cadenas laterales son los mismos independientemente de por que extremo de la cadena principal contemos, se tendrá en cuenta el orden alfabético de las ramificaciones.
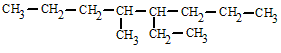
|
| 4-etil-5-metiloctano |
Ejemplos de alcanos y sus usos
- Cloroformo (nombre de fantasía del triclorometano; CHCl3) – los vapores de esta sustancia se usaban como anestésico en otros tiempos. Ya se dejó de usar con este fin porque se encontró que daña órganos importantes, como el hígado o los riñones. Su uso hoy es más que nada como disolvente o refrigerante.
- Metano (CH4) – este es e alcano más simple de todos: lo componen tan solo un átomo de carbono y cuatro de hidrógeno. Se trata de un gas que se produce de forma natural por la descomposición de diferentes sustratos orgánicos, y es el principal componente del gas natural. En los últimos tiempos se ha reconocido como uno de los gases que más aportan al llamado efecto invernadero.
- Octano (C8H18) – este es el alcano de ocho carbonos y tiene gran importancia puesto que determina la calidad final de las naftas, que es una mezcla de varios hidrocarburos. Esta calidad se mide por el índice de octanos u octanaje del combustible, que toma como referencia a uno poco detonante (índice 100) y a otro muy detonante (índice 0).
- Hexano (C6H14) – es un importante disolvente, debe evitarse su inhalación, ya que resulta muy tóxico.
- Butano (C4H10) – junto con el propano (C3H8), conforman los denominados gases licuados del petróleo (GLP), que se forman en las bolsas de gas durante los proceso de extracción del petróleo. Cada vez más se está promoviendo el reemplazo de la nafta o el diesel por GLP como combustible, ya que se trata de un hidrocarburo más amigable con el medio ambiente al emitir en su combustión solo anhídrido carbónico y agua.
- Icosano – así se llama al alcano de veinte carbonos (el prefijo ‘ico’ significa veinte)
- Ciclopropano – antiguamente se usaba como anestésico
- n-heptano – este alcano es el que se toma como referencia para el punto cero de la escala de octanaje de las naftas, que sería lo menos deseable, ya que arde de manera explosiva. Se obtiene de la resina de ciertas plantas.
Propiedades físicas y químicas
Las propiedades físicas de los alcanos están en gran medida determinadas por el número de átomos de carbono. Así por ejemplo, los alcanos que tienen entre 1 y 4 átomos de carbono son gases a temperatura ambiente; aquellos que tienen entre 5 y 17 átomos de carbono son líquidos a esa misma temperatura, y los que tienen 18 carbonos o más son sólidos a temperatura ambiente
Escasa solubilidad
En general, los alcanos son poco solubles en agua y a medida que aumenta el peso molecular la solubilidad se torna incluso menor. Por esta razón, el más soluble en agua es el metano (que tiene un solo átomo de carbono): 0,00002 g/ml (a 25 °C). En solventes orgánicos, sin embargo, la solubilidad es alta.
Baja densidad
Su densidad es menor que la del agua, por eso tienden a flotar; esto se ve muy bien cuando se producen derrames de hidrocarburos en el mar.
Punto de fusión variable
El punto de fusión depende del número de átomos de carbono (a mayor número, más elevado es el punto de fusión), pero también de la estructura: aquellas que son simétricas tienen un punto de fusión más alto que las asimétricas.
Pueden sufrir diversas reacciones químicas
Las más comunes son:
- Oxidación. Al combinarse con el oxígeno pueden formar dióxido de carbono y agua y liberar energía bajo la forma de calor. Esta es la típica reacción de combustión.
- Halogenación. Tanto el cloro como el bromo, el flúor y el yodo pueden sustituir a átomos de hidrógeno del alcano. El bien conocido cloroformo es un hidrocarburo halogenado (el triclorometano).
- Nitración. A altas temperaturas y en presencia de vapores de ácido nítrico, se puede producir la sustitución de un hidrógeno por el grupo -NO2, generándose un nitroalcano.
- Isomerización. Es la reestructuración de la molécula sin pérdida ni ganancia de átomos.
- Pirólisis. Es la descomposición por exposición a muy elevada temperatura.
Un hidrocarburo insaturado es un hidrocarburo en que algún átomo de carbono no está saturado (es decir, unido a otros cuatro átomos exclusivamente por enlaces simples) sino que tiene algún enlace doble o triple.
Los hidrocarburos insaturados pueden ser de dos tipos: alquenos (con dobles enlaces) y alquinos (con triples enlaces).
LOS ALQUENOS
Regla 1. Los alquenos son hidrocarburos que responden a la fórmula CnH2n. Se nombran utilizando el mismo prefijo que para los alcanos (met-, et-, prop-, but-....) pero cambiando el sufijo -ano por -eno.
[1] Eteno
[2] Propeno
[3] 2-buteno
[4] Ciclopenteno
Regla 2. Se toma como cadena principal la más larga que contenga el doble enlace. En caso de tener varios dobles enlaces se toma como cadena principal la que contiene el mayor número de dobles enlaces (aunque no sea la más larga) con terminación dieno, trieno, tetraeno, etc
[5] 5-metil-2-hepteno
[6] 2-etil-1,4-hexadieno
[7] 3-propil-1,4-heptadieno
Regla 3. La numeración comienza por el extremo de la cadena que otorga al doble enlace el localizador más bajo posible. Los dobles enlaces tienen preferencia sobre los sustituyentes
[8] 4-bromo-3-metil-1-penteno
[9] 5-bromo-4-cloro-2-penteno
[10] 5,6-dimetil-1,3,5-heptatrieno
Regla 4. Los alquenos pueden existir en forma de isómeros espaciales, que se distinguen con la notación cis/trans.
[11] cis-2-buteno
[12] trans-2-buteno
[13] trans-2-penteno
[14] cis-2-penteno
LOS ALQUINOS
Los alquinos son hidrocarburos que contienen al menos un enlace triple carbono-carbono en su estructura molecular. Los alquinos son una de las tres clases principales de hidrocarburos, junto con los alcanos y los alquenos.
La fórmula general de los alquinos es CnH2n-2, lo que significa que para cada átomo de carbono en la molécula, hay dos átomos de hidrógeno menos dos. Por ejemplo, el etino (también conocido como acetileno) es el alquino más simple y tiene una fórmula molecular de C2H2.
Los alquinos son importantes en la química orgánica porque pueden reaccionar con una variedad de compuestos para formar nuevos productos. Además, el enlace triple carbono-carbono es más reactivo que el enlace doble carbono-carbono en los alquenos, lo que permite que los alquinos participen en una amplia gama de reacciones químicas.
Características
1. Enlace triple carbono-carbono: El enlace triple carbono-carbono es la característica más distintiva de los alquinos. Este enlace es más reactivo que el enlace doble carbono-carbono presente en los alquenos, lo que permite que los alquinos se involucren en una amplia gama de reacciones químicas.
2. Insaturados: Al igual que los alquenos, los alquinos son hidrocarburos insaturados, lo que significa que contienen uno o más enlaces dobles o triples en su estructura molecular.
3. Bajo punto de ebullición: En general, los alquinos tienen un punto de ebullición más bajo que los alquenos y alcanos de igual peso molecular. Esto se debe en parte a su menor polaridad.
4. Solubilidad en agua: Debido a su baja polaridad, los alquinos son generalmente insolubles en agua, pero son solubles en disolventes orgánicos como el éter y el benceno.
5. Acidez: Los alquinos pueden actuar como ácidos debido a la presencia del enlace triple carbono-carbono, lo que les permite reaccionar con bases fuertes para formar sales.
6. Propiedades físicas: Los alquinos son gases o líquidos incoloros en condiciones normales de temperatura y presión. Son menos densos que el agua y tienen un olor ligeramente dulce y picante.
7. Usos: Los alquinos se utilizan en una variedad de aplicaciones industriales, incluyendo la soldadura y corte de metales, la síntesis de productos químicos y la producción de plásticos y fibras sintéticas. También se usan en la investigación y en la síntesis de compuestos orgánicos complejos.
Propiedades físicas y químicas
Propiedades físicas de los alquinos:
- Los alquinos son hidrocarburos no polares, lo que significa que tienen baja solubilidad en agua.
- Tienen puntos de fusión y ebullición más bajos que los alcanos y los alquenos de peso molecular similar debido a la menor fuerza de Van der Waals entre sus moléculas.
- La densidad de los alquinos es menor que la del agua.
Propiedades químicas de los alquinos:
- El enlace triple carbono-carbono en los alquinos es un enlace covalente altamente polarizado y, por lo tanto, se comporta como un grupo funcional muy reactivo.
- Los alquinos reaccionan fácilmente con el cloro y el bromo para formar haluros de alquino.
- Los alquinos pueden someterse a hidrogenación catalítica para formar alquenos y alcanos.
- Los alquinos son altamente ácidos debido a la presencia del hidrógeno unido al carbono triple. El hidrógeno ácido de los alquinos puede ser reemplazado por metales para formar sales de alquino.
- Los alquinos pueden someterse a adición de hidrógeno, haluros de hidrógeno, haluros de alquilo y alquenos para formar diversos productos orgánicos.
- Los alquinos también pueden someterse a polimerización para formar polímeros de alquino lineales y ramificados.
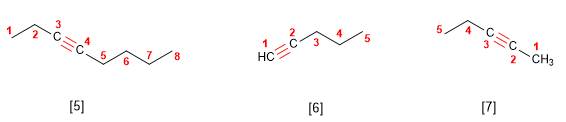
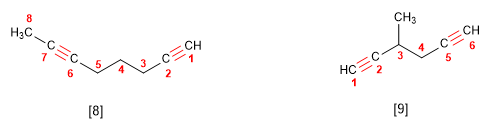
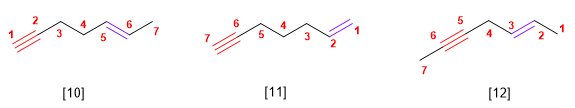
Nomenclatura
Regla 1. Los alquinos responden a la fórmula CnH2n−2 y se nombran sustituyendo el sufijo -ano del alcano con igual número de carbonos por -ino.