Unidad No. 6 "La Materia"
QUÉ ES MATERIA?
La materia en química y física es todo lo que ocupa un espacio y tiene masa, forma, peso y volumen. Por lo tanto, es lo que se puede observar y medir, un elemento físico o corpóreo en oposición a algo abstracto o espiritual. Se conoce también como sustancias o cuerpos, y contiene energía.
La materia está compuesta por átomos y partículas subatómicas, como lo son los neutrones, protones, electrones, cuarks o muones. Cada tipo de átomo corresponde a un elemento. Algunos ejemplos son hidrógeno, oxígeno, carbono, plomo o potasio. En este sentido, la materia puede ser compuesta por un solo elemento o una combinación de ellos.
Otra característica de la materia es que es propensa a cambiar en el tiempo. Las interacciones entre sustancias diferentes resultan en un intercambio de energía, lo que se traduce en cambios de estado, mezclas o reacciones químicas.
Con relación a los estados, la materia puede hallarse en cuatro estados fundamentales: sólido, líquido, gas y plasma. Variar de estado no cambia la naturaleza de la materia, pero sí la forma en la que sus partículas se distribuyen y enlazan.
Materia viene del latín mater, que significa madre, el origen o la fuente de la cual proviene alguna cosa.
Ejemplos de materia

Como la materia está definida como todo aquello que tiene masa y ocupa un espacio, cualquier organismo, forma de vida u objeto inerte es un ejemplo de materia.
Dicho de otra forma, estos pueden ser ejemplos concretos de materia:
· Un ser humano, que es materia orgánica viva compuesta por trillones de células que cumplen diferentes funciones. A su vez, se compone de una gran variedad de elementos y compuestos.
· Un animal o planta, con características similares a un ser humano en cuanto a composición de la materia.
· Una piedra, una materia inorgánica inerte y sólida formada por una variedad mucho menor de partículas. Los enlaces entre los átomos son fuertes, lo que se traduce en materia dura, difícil de romper con nuestras manos.
· El agua, una materia inorgánica formada por partículas de hidrógeno y oxígeno, y la única sustancia que solemos ver en estado líquido, sólido y gaseoso en nuestra vida cotidiana.
· Los alimentos, materia orgánica inerte que contiene elementos esenciales para nuestra dieta.
· El oro, una materia inorgánica de gran valor, pero que puede presentar impurezas (presencia de otras sustancias).
Clasificación de la materia
La materia se clasifica en tres formas: en sustancias puras o mezclas, en materia orgánica o inorgánica, y en materia viva o inerte.
Sustancias puras o mezclas
· Sustancias puras: son sustancias que mantienen su composición aunque cambien su estado. A su vez, las sustancias puras se dividen en:
o Elementos: son sustancias puras con un solo tipo de átomo y, por ello, no pueden descomponerse en sustancias más simples. Ejemplos: oxígeno (O), carbono (C), oro (Au) y sodio (Na).
o Compuestos: son sustancias puras con dos elementos o más, siempre presentes en cantidades fijas. En este caso, pueden descomponerse mediante procesos químicos específicos para obtener los elementos por separado. Ejemplos: el agua (H₂O), la glucosa (C6H12O6) y la sal de mesa o cloruro de sodio (NaCl).
· Mezclas: son combinaciones de elementos o sustancias, presentes en proporciones variables. Las mezclas, a su vez, se dividen en:
o Mezclas homogéneas: son mezclas en las que sus componentes no se pueden distinguir fácilmente. También se llaman disoluciones. Ejemplo: una cucharada de sal disuelta en un vaso de agua.
o Mezclas heterogéneas: son mezclas en las que sus componentes se pueden distinguir con facilidad. Ejemplo: echar un puñado de arena en un vaso de agua, pues la mayor parte de la arena queda sin disolverse.
Materia orgánica o inorgánica
Materia orgánica: la materia orgánica es toda sustancia basada en el carbono que contiene enlaces carbono-hidrógeno y/o carbono-carbono. Ejemplos: proteínas, carbohidratos, lípidos y ácidos nucleicos.
Materia inorgánica: es el resto de materia existente, incluyendo aquellas sustancias con carbono consideradas inorgánicas, como los carburos, óxidos de carbono, carbonatos o cianuros.
Materia viva o inerte
Materia viva: este tipo de materia se refiere a todo ser vivo, compuesto por multitud de elementos y compuestos que, en conjunto, forman ADN, núcleos, células, tejidos, órganos y cuerpos enteros. Los seres vivos, animales, plantas, hongos y microorganismos son materia viva.
Materia inerte: la materia inerte es toda sustancia no viva, que no realiza ningún tipo de función vital. Ejemplos: minerales, metales, agua, cuerpos celestes y los gases presentes en la atmósfera.
Estados de la Materia
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
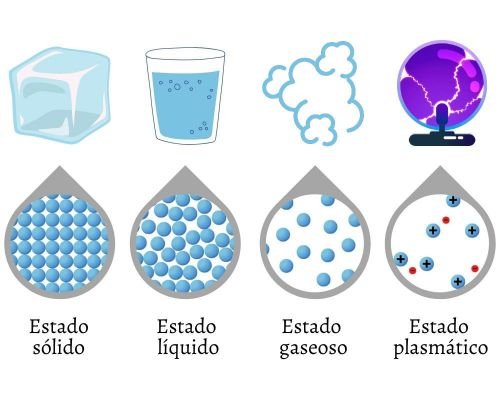
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
· Estado sólido.
· Estado líquido.
· Estado gaseoso.
· Estado plasmático.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
A continuación, presentamos un cuadro comparativo con las principales características y diferencias que existen entre los estados fundamentales de la materia:
| Propiedad |
Estado |
Estado líquido |
Estado gaseoso |
Estado plasmático |
|---|---|---|---|---|
| Tipo de materia | Materia fija | Fluidos con viscosidad | Gases |
Gases calientes (con carga eléctrica) |
|
Atracción entre partículas |
Alta | Intermedia | Baja | Baja |
|
Movilidad de partículas |
Baja | Intermedia | Alta | Alta |
| Volumen | Con volumen | Con volumen | Sin volumen | Sin volumen |
| Forma | Definida | Indefinida | Indefinida | Indefinida |
| Ejemplo | Piedras | Agua | Vapor de agua | TV de plasma |
Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.

Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Pueden tener un nivel de viscosidad variable, dependiendo de los elementos en los que se compone el líquido.
Algunos ejemplos de materia en estado líquido son: agua, bebidas refrigerantes, lava, mercurio a temperatura ambiente, aceite y saliva.
Las características del estado líquido son:
- Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
- Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
- Tiene un volumen constante.
- Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.

Estado gaseoso
El estado gaseoso corresponde a los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí que, al chocar unas con otras, se expanden en el espacio.
Algunos ejemplos de materia en estado gaseoso son: vapor de agua, oxígeno (O2), helio (He), el aroma de los perfumes, humo, el aire atmosférico y gas natural.
Las características del estado gaseoso son:
- La concentración de partículas en un mismo espacio es menor que la de los sólidos y los líquidos.
- Las partículas tienen poca atracción entre sí.
- Las partículas se encuentran en expansión, por lo cual son más dinámicas que los sólidos y los gases.
- No tiene forma ni volumen definido.

Estado plasmático
El estado plasmático es un estado semejante al gaseoso, pero posee partículas cargadas eléctricamente, es decir, ionizadas. Se trata, pues, de gases calientes.
La materia en estado plasmático es muy común en el espacio sideral y constituye, de hecho, el 99% de su materia observable. Sin embargo, el estado plasmático también se reproduce naturalmente en algunos fenómenos terrestres. Asimismo, se puede producir artificialmente para diversos usos.
Por ejemplo, hay plasma en el sol, las estrellas y las nebulosas. También está presente en las auroras polares, en los rayos y en el llamado Fuego de San Telmo. En cuanto a su producción artificial, algunos ejemplos son los televisores de plasma, los tubos fluorescentes y las lámparas de plasma.
Las características del estado plasmático son:
- Carece de forma y volumen definidos.
- Sus partículas están ionizadas.
- Carece de equilibrio electromagnético.
- Es buen conductor eléctrico.
- Forma filamentos, capas y rayos cuando se expone a un campo magnético.

